Số Nguyên Tử Là Gì ? Nguyên Tử Được Cấu Tạo Bởi Những Hạt Nào?
Trong hóa học lớp 10, cấu sản xuất nguyên tử là phần kiến thức cực kỳ quan trọng. Vậy được thành phần cấu tạo nguyên tử là gì? mô hình, sơ đồ cấu tạo sẽ giúp các bạn học sinh ứng dụng vào làm bài xích tập xuất sắc nhất. Hãy cùng VIETCHEM tìm hiểu về nguyên tử trong nội dung bài viết dưới đây.
Bạn đang xem: Số nguyên tử là gì
1. Thành phần cấu trúc nguyên tử là gì?3. Form size và trọng lượng của cấu trúc nguyên tử5. Phân lớp e trong kết cấu nguyên tử6. Các dạng bài bác tập về cấu trúc nguyên tử gồm những gì?
1. Thành phần cấu tạo nguyên tử là gì?

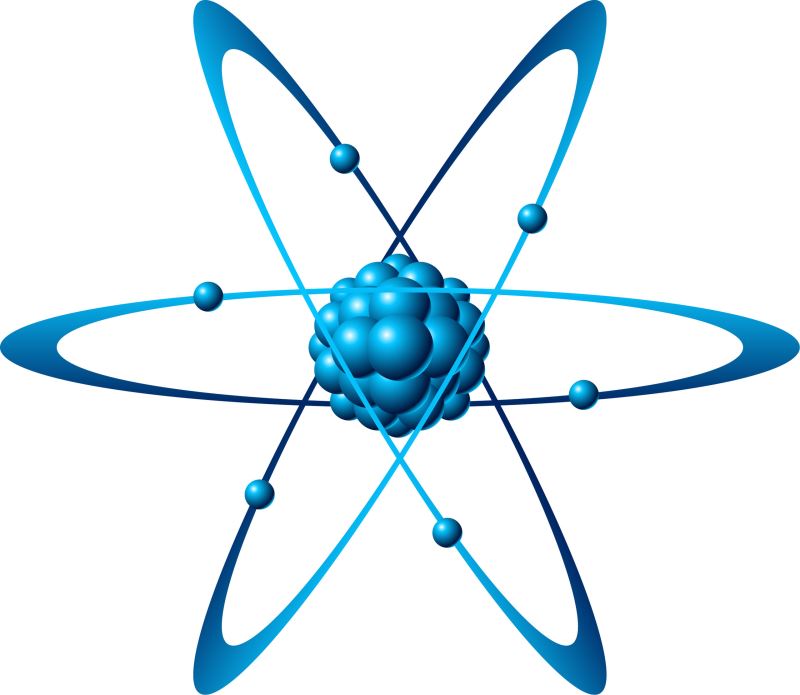
Hình hình ảnh cấu chế tạo ra vỏ nguyên tử trong hóa học
1.1. Nguyên tử là gì?
Nguyên tử là đơn vị cơ phiên bản của đồ dùng chất, bao gồm những phân tử vô cùng nhỏ và trung hòa về điện. Nguyên tử gồm một hạt nhân ở vị trí chính giữa và được phủ bọc bởi đám mây năng lượng điện âm electron.
Những nguyên tử thường có size rất nhỏ, đường kính chỉ bằng vài phần mười của nano mét. Nguyên tử kí hiệu là Z (tiếng Đức là Zahl)
1.2. Thành phần cấu tạo nguyên tử gồm những gì?
Thành phần cấu tạo của nguyên tử gồm 2 lớp: Vỏ nguyên tử với hạt nhân
Vỏ nguyên tử là gần như electron sở hữu điện tích âmHạt nguyên tử là gần như hạt sở hữu điện tích dương là phân tử proton và không sở hữu điện notron.
Như vậy, cấu tạo nguyên tử gồm 3 loại hạt kia là: electron, proton và notron. Trong đó, số electron bởi với số proton, trọng lượng của một proto = 1800 electron. Tùy thuộc vào điều kiện vật lý như mật độ, nhiệt độ, áp suất đang dẫn tới việc chuyển pha vật chất giữa rắn, lỏng khí cùng plasma.
Hạt | Điện tích | Khối lượng |
Proton | qp = – 1,602 x 10–19 C | mp = 1,6726.10-27kg |
Notron | qn = 0 | mn = 1,6726.10-27kg |
Electron | qe = – 1,602 x 10-19 C | me = 9,1094 x 10-31 kg |
2. Mô hình kết cấu nguyên tử
Sơ đồ tứ duy cấu tạo nguyên tử bao hàm lớp vỏ với lớp phân tử nhân links với nhau bằng các hạt với điện tích (-+) và các hạt không có điện. Gồm hạt dìm e cùng hạt nhịn nhường e tạo thành liên kết nguyên tử vững chắc.

Mô hình cấu trúc nguyên tử bao gồm những hạt nào (p,e,n)

3. Size và cân nặng của cấu trúc nguyên tử
3.1. Kích thước
Nguyên tử có kích thước rất là nhỏ, đường kính nguyên tử khoảng 10-10 m và của hạt nhân khoảng chừng 10-14 m.Đơn vị của kích thước nguyên tử là angstron (1Å = 10-10m) hoặc nanomet (1nm = 10-9m)
Đường kính nguyên tử khoảng 10-10 m và của hạt nhân khoảng chừng 10-14 m
3.2. Khối lượng nguyên tử
Khối lượng của nguyên tử triệu tập chủ yếu ớt ở hạt nhân, đo đó, trọng lượng nguyên tử nói một cách khác là cân nặng hạt nhân với đơn vị tính kí hiệu là u(đv
C)
Giá trị của 1u(đv
C) =1/12 trọng lượng của 1 nguyên tử cacbon. Trong đó: trọng lượng nguyên tử cacbon = 19,9265.10-27kg => 1u = 19,9265.10-27kg /12 = 1,6605.10-27kg
4. Sự không giống nhau giữa phân tử cùng nguyên tử
Sau khi vậy được thành phần cấu tạo nguyên tử là gì, bạn cũng có thể so sánh được sự khác nhau giữa nguyên tử và phân tử trải qua các tài liệu sau:
Đặc điểm | Nguyên tử | Phân tử |
Khái niệm | Nguyên tử là đơn vị chức năng cơ bạn dạng của vật chất, bao gồm những phân tử vô cùng nhỏ dại và trung hòa - nhân chính về điện. Nguyên tử bao gồm một hạt nhân tại chính giữa và được phủ quanh bởi đám mây năng lượng điện âm electron. | Phân tử bao gồm một số nguyên tử link với nhay với thể hiện tương đối đầy đủ tính hóa chất của một chất. |
Ví dụ | Nguyên tử Hydro, nguyên tử cacbon | Oxy (O2), nước (H2O) |
Hình dạng | Hình cầu | Nhiều hình dạng |
Tính chất | Nguyên tử bắt buộc phân đôi | Phân tử gồm thể bóc rời những nguyên tố và phối kết hợp lại cùng với nhau |
Tồn tại | Có thể mãi sau hoặc quan trọng tồn tại trong trạng thái tự do | Tồn tại trong tâm lý tự do |
Ngoại quan | Mắt thường xuyên không nhìn thấy | Mắt thường không thấy được được nhưng hoàn toàn có thể nhìn qua kính hiển vi |
Liên kết | Hạt nhân | Cộng hóa trị, cộng ion |
5. Phân lớp e trong kết cấu nguyên tử
5.1. Lớp e là gì?
Trong cấu trúc nguyên tử, lớp e là các electron có các mức tích điện gần bởi nhau, máy tự sắp xếp tăng dần từ mức năng lượng thấp cho đến mức tích điện cao cùng được tạo thành 7 lớp.
Mức tích điện n | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
Tên lớp | K | L | M | N | O | P | Q |
Bảng thống kê số electron Max trong những lớp

5.2. Phân lớp e
Lớp e gồm 4 phân lớp đó là s, p, d, f và có những e có các mức tích điện bằng nhau.
Phân lớp | s | p | d | f |
Số e tối đa | 2 | 6 | 10 | 14 |
Ký hiệu | s2 | p6 | d10 | f14 |
6. Các dạng bài xích tập về cấu tạo nguyên tử tất cả những gì?
Có 3 dạng bài xích tập về nguyên tử hay chạm mặt trong sách giáo khoa, đề thi học tập kỳ và đề thi đại học hóa học mà các bạn học sinh giỏi gặp. Thay được lý thuyết phần này đang là hành trang giải các bài tập nguyên tử, phân tử nhân dễ dàng hơn.

Các dạng bài tập về nguyên tử trong hóa học
6.1. Xác định nguyên tố
Dựa vào số Z của nguyên tử để xác định được nguyên tử này là nguyên tố chất hóa học nào
Z=p=e=ESố khối A = Z + NTổng số hạt mang điện là = Z + E = 2ZTổng số phân tử là = 2Z + N6.2. Nêu kết cấu nguyên tử
- cách 1: Lập phương trình dựa vào kết cấu vỏ nguyên tử cùng ion, tiếp nối giải ra để tìm được số hạt.
- giải pháp 2: phụ thuộc vào các loại kí hiệu của nguyên tử tiếp đến suy ra số phân tử của mỗi các loại nguyên tử
M → Mn + ne (nhường e)
(nhận e) X + me → Xm-
6.3. Viết cấu hình e
Bước 1: xác định số lượng e tất cả trong nguyên tử
Bước 2: Phân bố những electron với lắp thêm tự mức năng lượng tăng dần
Bước 3: Viết thông số kỹ thuật của những e theo vật dụng tự của những phân lớp electron trong và một lớp
7. Bài tập thực hành thực tế về cấu tạo nguyên tử
Sau khi nắm vững lý thuyết cũng như bài tập về cấu trúc nguyên tử chúng ta sẽ cùng thực hành một số trong những bài tập vào sách giáo khoa chất hóa học lớp 10 để giúp chúng ta củng chũm lại con kiến thức.

Giải bài xích tập nguyên tử trong chất hóa học lớp 10
Bài tập 1: Nêu cấu tạo nguyên tử của lớp hạt nhân gồm các loại phân tử nào?
A: electron, proton với nơtron
electron cùng nơtronproton với nơtron electron với protonLời Giải: Đáp án C
Bài tập 2: Hạt sở hữu điện tích dương trong kết cấu nguyên tử và link hóa học là:
electron cùng proton protonproton với notron notronLời Gải: Đáp án B
Bài tập 3: khối lượng nguyên tử cacbon -12 là bao nhiêu?
1u 12 gam1 đvC 12u
Lời Giải: Đáp án D
Bài tập 4: hạt nhân X bao gồm tổng số hạt cơ phiên bản là 40, tổng số hạt có điện nhiều hơn số hạt không mang điện là 12 hạt. Vậy phân tử nhân X gồm số phân tử là bao nhiêu?
Lời Giải:
Trong nguyên tử số p=e buộc phải tổng số hạt sẽ được tính là: 2P + N=40
Số hạt có điện tích nhiều hơn thế số hạt không mang điện tích là 12 => 2P - N = 12
Giải phương trình ta được: phường = 13 với N = 14 => hạt nhân X có số phân tử là p. + N = 27 hạt
Bài tập 5: X tất cả tổng số hạt cơ bạn dạng là 18. Hãy tính số hạt mang điện tích dương trong X
Lời Giải:
Theo lý thuyết: Đối với những nguyên tố có Z
Theo đề bải ta có 2Z + N = 18
Vì Z 5,11 ≤ Z ≤ 6
Trong đó, Z luôn luôn nguyên => Z = 6
Kết luận: Số hạt mang điện tích dương vào X là 6 hạt
Bài tập 6: Canxi kim loại có trọng lượng riêng là 1,55 g/cm3 . Ví như trong tinh thể canxi những nguyên tử là hình cầu chiếm 74% thể tích tinh thể, phần còn sót lại là khe rỗng, cho NTK của Ca là 40đv
C, Hãy tính nửa đường kính nguyên tử canxi
Lời Giải:
- Ta có 1cm3 tinh thể canxi có cân nặng 1,55 gam, tổng thể tích những nguyên tử canxi là 0,74cm3
- 1,55 gam canxi tương ứng với 0,03875 mol xuất xắc 2,325.1022 nguyên tử.
- Thể tích 1 nguyên tử canxi là 3,18.10-23 cm3. Mà coi nguyên tử là hình mong vậy nửa đường kính nguyên tử canxi là 1,96.10-8 cm hay 0,196nm.
Nắm được những thành phần cấu tạo thành nguyên tử bao có những gì để giúp đỡ bạn tất cả thêm triết lý và áp dụng vào làm bài bác tập cho kết quả đúng mực nhất. đọc thêm các dạng bài bác tập hóa học khác bên trên website vietchem.com.vn.
Như chúng ta đã biết đầy đủ vật thể trong tự nhiên cũng tương tự trong nhân tạo được tạo vì chưng một chất này hay một chất như thế nào khác. Vậy thắc mắc được đề ra tiếp theo là các chất này được tạo thành từ đâu? Đây là thắc mắc đã được đặt ra từ mặt hàng nghìn năm kia và được các nhà công nghệ giải đáp bằng khái niệm “nguyên tử”. Thuộc tìm hiểu chi tiết trong bài viết tổng hợp sau đây của vabishonglam.edu.vn!

1805: John Dalton là bên Hóa học, thứ lý học và nhà Khí tượng học lừng danh người Anh. Ông cũng là giữa những người đón đầu trong thuyết nguyên tử tân tiến đã áp dụng khái niệm về nguyên tử để giải thích lý do những nguyên tố luôn luôn phản ứng theo các số trường đoản cú nhiên bé dại cũng như bao gồm loại khí có thể hòa tung trong nước xuất sắc hơn gần như khí khác.
“Mỗi nguyên tố hóa học chứa số đông nguyên tử thuộc loại, nhất và phần đa nguyên tử này kết hợp với nhau chế tạo thành phần lớn hợp chất hóa học”. (Wikipedia.org)
Trong thuyết nguyên tử này, không tồn tại thông tin về kích thước rõ ràng của nguyên tử nhưng chỉ được chứng thực qua giác quan là “rất nhỏ”.
1827: Robert Brown - nhà thực đồ học nổi tiếng người Scotland đã thực hiện kính hiển nhằm quan sát những hạt lớp bụi trôi nổi xung quanh nước. Cơ hội này, ông nhận ra rằng chúng dịch chuyển theo hình zic - zắc.
1865: Johann Josef Loschmidt – một công ty khoa học tín đồ Áo tất cả bước tiến cải tiến vượt bậc khi nghiên cứu và phân tích về nguyên tử. Thay thể, ông đang tìm ra kích cỡ của phân tử trong ko khí.
1905: Albert Einstein – Nhà thiết bị lý học khổng lồ người Đức đang phân tích thành công cân nặng và kích cỡ nguyên tử cũng như xác nhận thuyết nguyên tử của nhà Hóa học, đồ lý học tập John Dalton.
Xem thêm: " For Có Nghĩa Là Gì ? (Từ Điển Anh (Từ Điển Anh
Khái niệm Nguyên tử là gì?
Thực tế gồm đến hàng chục triệu chất khác biệt nhưng chỉ có tầm khoảng hơn 100 loại nguyên tử. Nguyên tử được hình dung giống như một quả cầu rất nhỏ xíu nhỏ, đường kính chỉ khoảng tầm 0.00000001 cm.
Sách giáo khoa chất hóa học 8 (Nhà xuất phiên bản Giáo dục Việt Nam) tư tưởng về nguyên tử như sau:
“Nguyên tử là hạt vô cùng nhỏ dại và trung hòa - nhân chính về điện. Nguyên tử bao gồm hạt nhân với điện tích dương và vỏ tạo bởi vì một hay các electron sở hữu điện tích âm”.
Electron cam kết hiệu là e có điện tích âm nhỏ tuổi nhất cùng được quy mong ghi bằng dấu âm (-).
bí kíp giúp trẻ con 10 tuổi xuất sắc cả 4 kĩ năng tiếng Anh
Gợi ý bài xích tập ứng dụng đạo hàm trong kinh tế tài chính và giải pháp học hiệu quả
Oxit axit: Định nghĩa, cách gọi tên, đặc điểm và bài tập thực hành
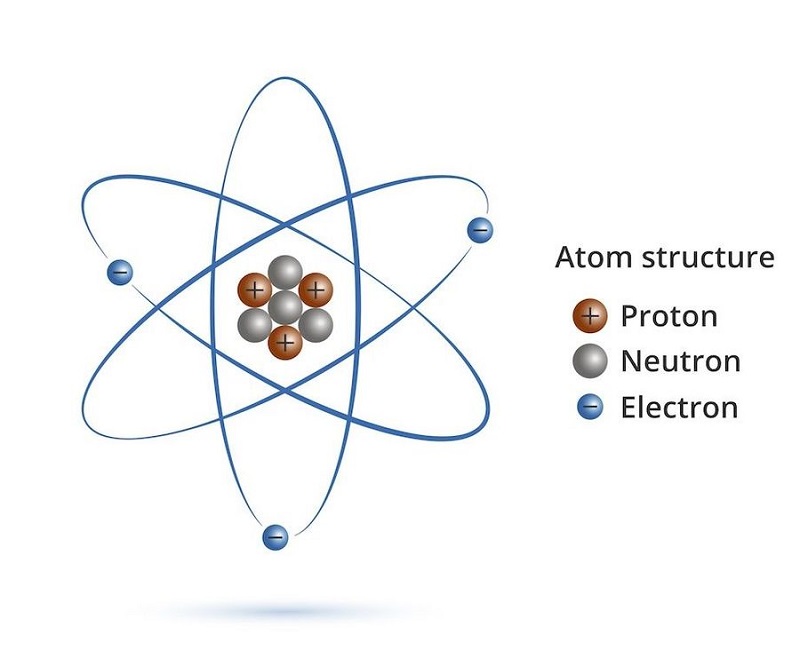
Nguyên tử được kết cấu bởi các hạt nào?
Dựa vào tư tưởng nguyên tử là gì sinh sống trên ta hoàn toàn có thể nhận thấy ví dụ rằng, nguyên tử được kết cấu bởi 2 loại, bao hàm hạt nhân có điện tích dương với vỏ tạo vì một hay nhiều electron có điện tích âm.
Một số định nghĩa khác liên quan đến nguyên tử
Để gọi rõ bản chất nguyên tử là gì, bọn họ cũng nên tò mò một số khái niệm liên quan đến nguyên tử, bao hàm hạt nhân nguyên tử, lớp electron trong nguyên tử hay tư tưởng về nguyên tử khối.

Hạt nhân nguyên tử
Hạt nhân nguyên tử được tạo do proton với nơtron, nằm ở vị trí chính giữa của nguyên tử. Proton ký kết hiệu là p và bao gồm điện tích như electron nhưng lại khác vệt (ghi bởi dấu dương +). Nơtron không sở hữu điện, cam kết hiệu là n. Những nguyên tử cùng loại đều sở hữu số proton trong phân tử nhân.
Trong một nguyên tử có bao nhiêu proton thì cũng có thể có bấy nhiêu electron. Kết luận số p. = số e. Thực tế, proton với nơtron bao gồm cùng khối lượng còn electron có trọng lượng rất nhỏ, chỉ bằng khoảng 0.0005 lần proton. Vày vậy, các nhà khoa học coi khối lượng phân tử nhân bao gồm là cân nặng của nguyên tử.
Lớp e vào nguyên tử
Trong nguyên tử thì electron luôn chuyển động rất cấp tốc quanh phân tử nhân và sắp xếp thành từng lớp cùng với số electron độc nhất vô nhị định. Và nhờ electron nhưng mà nguyên tử có chức năng liên kết với nhau.
Số nguyên tử
Trên bảng tuần trả hóa học, mỗi phân tử đều sở hữu số nguyên tử riêng biệt của nó. Phụ thuộc vào số nguyên tử, bạn có thể phân biệt một trong những phần tử này với các thành phần khác.
Số nguyên tử là gì? Số nguyên tử đó là số lượng proton được search thấy trong phân tử nhân nguyên tử của nguyên tố hóa học đó. Vào trường phù hợp nguyên tử đó không tồn tại điện tích thì số lượng nguyên tử bằng số electron.
Nguyên tử khối
“Nguyên tử khối là khối là khối lượng của một nguyên tử tính bằng đơn vị chức năng cacbon. Mỗi nguyên tố tất cả nguyên tử khối riêng biệt” (Sách giáo khoa chất hóa học 8, đơn vị xuất bản Giáo dục Việt Nam).
Chính bởi vì nguyên tử có khối lượng rất nhỏ, không tiện áp dụng nên các nhà kỹ thuật đã quy ước lấy 1/12 trọng lượng của nguyên tử cacbon làm đối chọi vị cân nặng cho nguyên tử (viết tắt đv
C).
Phân biệt nguyên tử cùng phân tử
Trong thừa trình mày mò về nguyên tử, không ít các bạn nhầm lẫn nguyên tử và phân tử. Vậy minh bạch 2 có mang này như vậy nào?
Đặc điểm so sánh | Nguyên tử | Phân tử |
Khái niệm | Nguyên tử là hạt vô cùng nhỏ dại và th-nc về điện. Nguyên tử có hạt nhân sở hữu điện tích dương cùng vỏ tạo bởi vì một hay các electron với điện tích âm. | Phân tử là hại thay mặt cho chất, gồm một số trong những nguyên tử link với nhau cùng thể hiện rất đầy đủ tính hóa chất của chất. |
Ví dụ | Nguyên tử oxi, nguyên tử cacbon | Oxy (O2), nước (H2O) |
Hình dạng | Hình cầu | Nhiều hình dáng |
Tính chất | Không thể phân đôi nguyên tử | Các yếu tố trong phân tử tất cả thể bóc rời và kết hợp với nhau. |
Sự tồn tại | Có thể mãi sau hoặc ko tồn tại nghỉ ngơi trạng thái trường đoản cú do | Tồn tại trong trạng thái tự do |
Tầm nhìn | Không nhìn thấy bởi mắt thường | Không thể quan sát thấy bởi mắt thường nhưng lại nếu tất cả kính hiển vi vẫn hoàn toàn có thể quan sát |
Khả năng làm phản ứng | Phản ứng cao, có ngoại lệ độc nhất vô nhị định | Ít bội phản ứng |
Liên kết | Liên kết hạt nhân | Liên kết cùng hóa trị hoặc liên kết cộng ion |
Bài tập củng cố kỹ năng bài học tập về nguyên tử
Sau khi nắm rõ lý thuyết, bạn đừng quên làm những bài tập trong sách giáo khoa, sách bài tập tuyệt sách bổ trợ để ghi nhớ con kiến thức chắc thêm nhé. Dưới đó là một vài bài xích tập vabishonglam.edu.vn tổng phù hợp từ sách giáo khoa chất hóa học 8 (NXB giáo dục đào tạo Việt Nam) cùng gợi ý đáp án để bạn tham khảo.

Bài 1: Ôn tập có mang nguyên tử
“(1) là hạt khôn xiết nhỏ, th-nc về điện: từ bỏ (2) tạo nên mọi chất. Nguyên tử gồm (3) mang điện tích dương và vỏ tạo do (4)”.
Gợi ý đáp án:
(1): Nguyên tử
(2): nguyên tử
(3) phân tử nhân
(4) một hay những electron sở hữu điện tích âm
Bài 2: bài bác tập ôn tập SGK chất hóa học 8 trang 25
Kim một số loại đồng, sắt được khiến cho từ nhân tố nào? Nêu sự sắp xếp nguyên tử trong 1-1 chất kim loại.
Gợi ý đáp án:
Kim một số loại đồng được làm cho từ thành phần Cu; sắt kẽm kim loại sắt được tạo nên từ yếu tố Fe;
Sự bố trí nguyên tử trong solo chất kim loại: chúng được sắp xếp khít nhau và theo một riêng biệt tự xác định.
Nguyên tử là bài xích học đặc biệt quan trọng trong lịch trình Hóa học tập THCS. Vì vậy, chúng ta đừng quên ôn tập kỹ năng và kiến thức thật kỹ tương tự như làm bài tập không thiếu thốn để nắm vững kiến thức về bài học này nhé. vabishonglam.edu.vn chúc các bạn học tập thiệt tốt!









