THẾ NÀO LÀ ĐIỂM TƯƠNG ĐƯƠNG LÀ GÌ, ĐIỂM TƯƠNG ĐƯƠNG LÀ:



Liên kết website
Đại học Duy Tân
Cổng thông tin sinh vabishonglam.edu.vnên
Diễn lũ Duy Tân
Đoàn bạn teen - Đại học Duy Tân



KHOA KHOA HỌC TỰ NHIÊN
Phụ trách những học phần thuộc Khối kiến thức giáo dục và đào tạo đại cưng cửng trong các chương trình đào tạo tại Trường Đại học Duy Tân.
Bạn đang xem: Điểm tương đương là gì
KHOA KHOA HỌC TỰ NHIÊN
Đảm nhận những học phần Toán học, Vật lý, Hóa học và Sinh học ở những chương trình huấn luyện của Trường.
KHOA KHOA HỌC TỰ NHIÊN
desgin chương trình, kế hoạch huấn luyện và chủ trì tổ chức quá trình đào sinh sản các học phần Toán học, Vật lý, Hóa học và Sinh học đại cương.
Nguyên tắc chung
phương thức phân tích thể tích là phương thức phân tích định lượng dựa vào vabishonglam.edu.vnệc đo thể tích của dung dịch chuẩn VB (là dung dịch vẫn biết đúng đắn nồng độ) chức năng vừa đủ với thể tích nhất quyết của chất phải phân tích VA (còn điện thoại tư vấn là chất định phân).
bội nghịch ứng phân tích: A + B → sản phẩm, phản bội ứng này vừa lòng 3 yêu ước của phản bội ứng phân tích:
- làm phản ứng xảy ra trọn vẹn theo 1 chiều.
- bội phản ứng xẩy ra nhanh không tồn tại sản phẩm phụ.
- Có cách thức xác định điểm tương đương.
Ví dụ: xác định nồng độ của hỗn hợp Na
OH bằng dung dịch chuẩn chỉnh HCl 0,1M.
+ rước 10 ml hỗn hợp Na
OH (A) cho vào bình nón.
+ nhỏ dại 2, 3 giọt phenolphtalein → dung dịch màu hồng.
+ rước dung dịch HCl 0,1M bỏ vô buret, chỉnh về vạch số 0.
+ nhỏ tuổi dần HCl từ bỏ buret vào trong bình nón lắc phần đông đến khi vừa mất màu, ngừng lại, ghi thể tích đã tiêu hao VHCl.
Một số tư tưởng và khái niệm
- Như ví dụ ngơi nghỉ trên, quy trình thêm thanh nhàn dung dịch chuẩn B từ buret vào dung dịch chất xác định A để thực hiện phản ứng phân tích gọi là quá trình định phân giỏi sự chuẩn độ.
- thời gian mà chất B cung cấp vừa đủ để công dụng hết với hóa học A theo phương trình phản nghịch ứng hotline là điểm tương đương.
- Để phân biệt được điểm tương đương thường tín đồ ta dùng chất chỉ thị. Chất thông tư có quánh tính thay đổi màu trên điểm tương đương trong quy trình định phân. Thời điểm mà màu của chỉ thị biến đổi rõ rệt để dựa vào đó ta kết thúc sự định phân được hotline là điểm chấm dứt sự định phân tuyệt điểm cuối chuẩn chỉnh độ.
- trong trường phù hợp tưởng thì điểm hoàn thành định phân trùng với điểm tương đương. Nhưng mà trong thực tiễn điểm xong định phân thường lệch lạc với điểm tương đương. Điều này gây nên sai số được cho phép định phân.
- hỗn hợp B đang biết nồng độ đúng đắn và được dùng để xác định nồng độ của những dung dịch khác được call là dung dịch chuẩn. tất cả 2 cách thức để pha dung dịch chuẩn:
+ cân trên cân nặng phân tích (chính xác đến 0,0002g) một lượng chất nào đó, tiếp đến hòa tan vào trong bình định mức. Biết được lượng hóa học (g), thể tích hỗn hợp thu được, ta dễ ợt tính được độ chuẩn của nó: T = g/ml.
+ Trong thực tế pha dung dịch chuẩn người ta thường dùng các ống chuẩn “fixanal”. Đó là hồ hết ống chất thủy tinh hoặc nhựa có chứa một lượng hóa học nào này đã được cân đúng chuẩn hoặc tiện tích chính xác của hỗn hợp chuẩn quan trọng để trộn 1 lít dung dịch với nồng độ đã biết bao gồm xác, ví dụ 0,1N; 0,05N…
Dung dịch chuẩn biết nồng độ đúng đắn như trong trường phù hợp này call là dung dịch nơi bắt đầu và chất tương xứng gọi là chất gốc, hỗn hợp gốc còn được gọi là dung dịch tiêu chuẩn.
* Yêu ước của chất gốc:
- nên tinh khiết về phương diện hóa học, tạp hóa học không lớn hơn 0,05-0,1%, có thể kết tinh lại được và sấy khô tại 1 nhiệt độ độc nhất vô nhị định.
- thành phần hóa học buộc phải ứng đúng với cách làm hóa học. Ví dụ, những tinh thể ngậm nước phải đúng với số phân tử theo công thức hóa học.
- chất gốc và dung dịch tiêu chuẩn chỉnh phải bền trong thời hạn giữ gìn với nồng độ đề xuất không đổi theo thời gian.
- Mol đương lượng của hóa học gốc càng phệ càng tốt để tăng độ đúng đắn khi xác định nồng độ của dung dịch.
cũng chính vì gọi là hỗn hợp tiêu chuẩn vì nó được sử dụng để khẳng định nồng độ của những chất khác.
nhưng trong thực tế không buộc phải mọi dung dịch chuẩn đều đáp ứng được yêu mong trên, chẳng hạn như HCl, Na
OH… vày vậy so với loại chất này người ta pha với nồng độ giao động (dùng ống đong, cân kĩ thuật). Tiếp đến người ta dùng dung dịch chuẩn chỉnh gốc để xác minh lại độ đậm đặc của hỗn hợp trên. Ví dụ, mật độ của dung dịch Na
OH hoàn toàn có thể xác định bằng dung dịch nơi bắt đầu là axit oxalic (H2C2O4.2H2O). Dung dịch chuẩn chỉnh mà nồng độ của nó bạn ta xác định được nhờ dung dịch gốc hotline là dung dịch đang được chuẩn hóa hay dung dịch chuẩn.
Trong thực tế nồng độ của dung dịch chuẩn không đề nghị lúc nào cũng khá được xác định bằng một dung dịch cội nào đó. Ví dụ, khi xác minh nồng độ hỗn hợp Na
OH rất có thể dùng dung dịch chuẩn HCl, độ đậm đặc của dung dịch đó lại được xác minh bằng dung dịch gốc khác, ví dụ điển hình dung dịch cội borat natri Na2B4O.10H2O giỏi Na2CO3 khan. Bằng phương pháp này có thể tiết kiệm được chất gốc nhưng lại kém đúng đắn hơn bởi vì sai số của phép chuẩn chỉnh độ.
bao gồm trường hợp bạn ta khẳng định nồng độ bằng cách thức trọng lượng. Ví dụ, xác minh nồng độ HCl theo Ag
Cl bằng phương pháp cho dung dịch HCl công dụng với hỗn hợp Ag
NO3.
Các bội phản ứng cần sử dụng trong đối chiếu thể tích
Một quánh điểm quan trọng của cách thức phân tích thể tích là không sử dụng dư thuốc thử mà luôn luôn theo đúng phương trình phản bội ứng, tuân thủ theo đúng định quy định đương lượng. Như vậy ví dụ là khi định phân phải xác minh được điểm tương đương. Trong một số trường hòa hợp vabishonglam.edu.vnệc khẳng định điểm tương đương rất dễ dàng dàng, dựa vào sự thay đổi màu của dung dịch trong thừa trình chuẩn độ. Ví dụ, định phân dung dịch Fe
SO4 bởi KMn
O4 trong môi trường thiên nhiên axit:
8H+ + 5Fe2+ + Mn
O4- → 5Fe3+ + Mn2+ + 4H2O
mỗi lần thêm giọt KMn
O4 thì màu biến mất rất nhanh vị ion Fe2+ khử màu tím của Mn
O4- mang lại Mn2+ không màu. Nhưng khi toàn cục Fe2+ bị oxi hóa hết thì 1 giọt thừa KMn
O4 sẽ làm cho dung di chuyển sang màu hồng hoặc tím nhạt. Điều này tạo nên rằng điểm tương tự đã thừa hay nói theo cách khác điểm ngừng định phân xuất hiện. Như vậy cụ thể là họ đã không xong xuôi định phân trên điểm tương đương mà khá quá một ít và do đó sẽ lộ diện sai số chuẩn chỉnh độ. Vì chưng nồng độ của dung dịch KMn
O4 siêu loãng với lượng thừa không tới một giọt vì thế sai số rất nhỏ và rất có thể bỏ qua.
phản bội ứng dùng ở lấy một ví dụ trên hotline là phản ứng tự chỉ thị. Nhưng trong thực tế đa số các phép định phân phải dùng chỉ thị từ bên cạnh vào, lấy một ví dụ khi xác định nồng độ Cl- sử dụng dung dịch chuẩn là Ag
NO3 với chỉ thị là K2Cr
O4, hoặc trong phương thức trung hòa người ta sử dụng metyl da cam, phenolphtalein.
Tóm lại, những phản ứng hóa học được áp dụng trong trong phân tích thể tích phải thỏa mãn nhu cầu các yêu mong sau đây:
- chất định phân phải phản ứng trọn vẹn với thuốc test theo một bội phản ứng tuyệt nhất định.
- phản nghịch ứng phải xẩy ra nhanh và lựa chọn lọc, tức là thuốc thử chỉ tác dụng với chất định phân chứ không chức năng với các chất khác tất cả lẫn trong dung dịch phân tích.
Xem thêm: Slide Master Là Gì? 2 Cách Tạo Slide Master Trong Powerpoint 2010
- Phải có chất thông tư thích hợp được cho phép xác định tương đối chính xác điểm tương đương.
bởi vì những yêu thương cầu nghiêm ngặt nói trên nhưng mà số phản nghịch ứng sử dụng được trong so sánh thể tích tương đối không nhiều. Người ta thường dùng 2 một số loại phản ứng chính:
+ những phản ứng kết hợp ion, bao gồm các phản nghịch ứng axit – bazơ, các phản ứng chế tạo ra phức, và các phản ứng tạo thành kết tủa khó khăn tan.
các điểm tương tự là một trong các số đó hai hóa chất đã phản bội ứng trả toàn. Trong số phản ứng axit-bazơ, điểm này cho biết khi toàn cục axit hoặc bazơ đã làm được trung hòa. Tư tưởng này là bánh mì từng ngày của những phép chuẩn độ hoặc revabishonglam.edu.vnew thể tích cùng được xác minh bằng các phép đo lường và tính toán học đối kháng giản.
Nhưng bởi cấp là gì? Đó là một quy trình trong này được thêm vào trong 1 cách cẩn thận, nhân thể tích dung dịch bao gồm nồng độ vẫn biết, điện thoại tư vấn là chất chuẩn độ, mang đến dung dịch có nồng độ chưa biết, nhằm thu được mật độ của nó.

vabishonglam.edu.vnệc sử dụng chỉ thị p
H cho phép biết thời điểm dứt chuẩn độ. Chỉ số được chế tạo dung dịch đang được chuẩn độ để triển khai định lượng mật độ mà bạn muốn biết. Một chỉ thị axit-bazơ là một hợp chất hóa học có màu phụ thuộc vào mật độ hydro hoặc p
H của môi trường.
Tuy nhiên, sự chuyển đổi màu của thông tư đến điểm hoàn thành chuẩn độ, nhưng lại không phải là vấn đề tương đương. Lý tưởng duy nhất là cả nhị điểm phải phù hợp; tuy nhiên trong thực tế, sự biến hóa màu sắc hoàn toàn có thể xảy ra một vài ba giọt sau khi quy trình trung hòa axit hoặc bazơ được hoàn thành.
Chỉ số
1 điểm tương tự là gì??1.1 Điểm cuối2 Điểm tương tự của phép chuẩn chỉnh độ axit mạnh dạn với bazơ mạnh3 mặt đường cong chuẩn độ axit yếu ớt - bazơ mạnh3.1 Giai đoạn3.2 gạn lọc chỉ tiêu theo điểm tương đương4 tư liệu tham khảoĐiểm tương tự là gì?
Một hỗn hợp axit gồm nồng độ không xác minh được để trong bình hoàn toàn có thể được chuẩn chỉnh độ bằng phương pháp thêm thảnh thơi dung dịch natri hydroxit có nồng độ sẽ biết bằng phương pháp sử dụng buret..
vabishonglam.edu.vnệc lựa chọn 1 chỉ thị đề xuất được tiến hành theo phương pháp nó chuyển đổi màu nhan sắc tại điểm mà cùng một lượng tương tự hóa học tập của dung dịch chuẩn chỉnh độ cùng dung dịch nồng độ chưa chắc chắn đã bội phản ứng.
Đây là vấn đề tương đương, trong lúc điểm tại đó chỉ báo thay đổi màu được gọi là điểm kết thúc, nơi xong xuôi chuẩn độ.
Điểm cuối
Sự ion hóa hoặc phân ly của chất chỉ thị được trình diễn như sau:
HIn + H2Ôi Trong- + H3Ôi+
Và vì vậy có một hằng số Ka
Ka =
Mối tình dục giữa chỉ báo không phân tách bóc (HIn) và chỉ báo phân bóc tách (Trong-) xác định màu của Chỉ báo.
vabishonglam.edu.vnệc bổ sung cập nhật một axit làm cho tăng độ đậm đặc HIn và tạo thành màu 1 của chất chỉ thị. Trong những khi đó, vabishonglam.edu.vnệc bổ sung cập nhật một cửa hàng ủng hộ sự ngày càng tăng nồng độ của chỉ số phân bóc tách (Trong-) (màu 2).
Điều mong mỏi muốn là vấn đề tương đương trùng với điểm cuối. Để có tác dụng điều này, một chỉ báo có tầm khoảng thời gian biến hóa màu bao hàm điểm tương đương được chọn. Không tính ra, đó là về vabishonglam.edu.vnệc giảm ngẫu nhiên lỗi nào tạo nên sự khác hoàn toàn giữa điểm tương đương và điểm cuối.
Tiêu chuẩn hóa hoặc nhận xét một chiến thuật là một quy trình trong kia nồng độ đúng mực của một phương án được xác định. Đó là cách thức một nấc độ, nhưng chiến lược theo sau là không giống nhau.
Một dung dịch của tiêu chuẩn chỉnh chính được đặt trong bình cùng dung dịch chuẩn độ vẫn được chuẩn chỉnh hóa nhận thêm vào bởi buret..
Điểm tương tự của phép chuẩn chỉnh độ axit to gan với bazơ mạnh
100 ml dung dịch HCl 0,1 M được đặt vào bình và hỗn hợp Na
OH 0,1 M có thêm dần bằng phương pháp buret, xác minh sự biến đổi p
H của dung dịch tạo thành axit clohydric.
Ban đầu trước khi thêm Na
OH, p
H của dung dịch HCl là 1.
Chất bazơ mạnh mẽ (Na
OH) được sản xuất và độ p
H tăng dần, tuy thế nó vẫn là độ p
H axit, do lượng axit dư thừa quyết định độ p
H này.
Nếu bạn liên tục thêm Na
OH, sẽ đến lúc đạt đến điểm tương đương, trong số ấy độ p
H là trung tính (p
H = 7). Axit sẽ phản ứng với bazơ được tiêu thụ, cơ mà vẫn chưa xuất hiện dư quá bazơ.
Chủ yếu là độ đậm đặc natri clorua, một loại muối trung tính (cũng không phải là Na+ cũng chưa hẳn Cl- thủy phân).
Nếu Na
OH liên tiếp được thêm vào, độ p
H tiếp tục tăng, trở cần cơ phiên bản hơn điểm tương đương, vị nồng độ Na
OH chiếm ưu thế.
Lý tưởng duy nhất là sự biến hóa màu của chỉ thị sẽ xảy ra ở p
H = 7; nhưng vị hình dạng bất ngờ của đường chuẩn chỉnh độ, phenolphtalein hoàn toàn có thể được sử dụng để đưa sang color hồng nhạt sinh sống độ p
H khoảng chừng 8.
Đường cong chuẩn độ axit yếu - bazơ mạnh
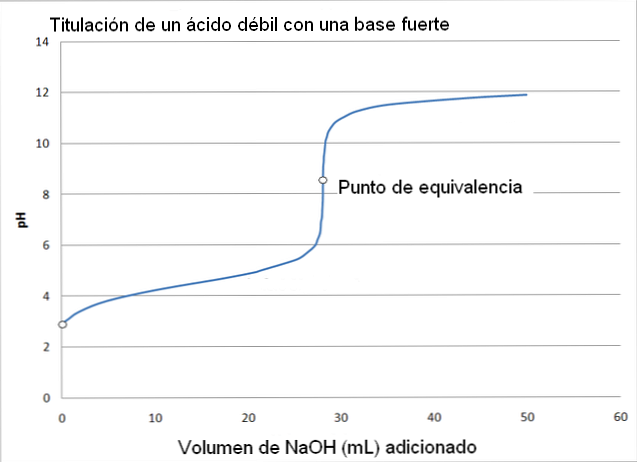
H bất thần hơn nhiều; trong những khi đó sinh hoạt đường chuẩn chỉnh độ của axit yếu gồm bazơ mạnh, có thể thấy rằng sự thay đổi diễn ra thảnh thơi hơn.
Trong trường vừa lòng này, một axit yếu hèn được chuẩn chỉnh độ, chẳng hạn như axit axetic (CH3COOH) với 1 bazơ mạnh, natri hydroxit (Na
OH). Phản bội ứng xảy ra trong thừa trình chuẩn chỉnh độ hoàn toàn có thể được sơ vật hóa theo phong cách sau:
Na
OH + CH3COOH => CH3COO-Na+ + H2Ôi
Trong trường hợp này, dung dịch đệm acetate được hình thành với p
Ka = 4,74. Vùng đệm rất có thể được bắt gặp trong sự thay đổi nhỏ tuổi và gần như không thể nhận biết trước p
H 6.
Điểm tương đương, như được chỉ ra vị hình ảnh, là khoảng tầm 8,72 chứ không hẳn 7. Tại sao? bởi CH3COO- là 1 trong những anion mà sau khi thủy phân tạo nên OH-, mà địa thế căn cứ vào độ p
H:
CH3COO- + H2Ôi CH3COOH + OH-
Các giai đoạn
vabishonglam.edu.vnệc chuẩn chỉnh độ axit axetic bởi natri hydroxit có thể được chia thành 4 tiến trình để phân tích.
-Trước khi ban đầu thêm bazơ (Na
OH), p
H của hỗn hợp là axit và dựa vào vào sự phân ly của axit axetic.
-Khi natri hydroxit được thêm vào, bộ đệm acetate được hình thành, nhưng theo phong cách tương tự, sự xuất hiện của đại lý acetate phối hợp tăng lên, làm tăng cường mức độ p
H của dung dịch.
-Độ p
H của điểm tương đương xẩy ra ở p
H là 8,72, đó là chất kiềm trực tiếp thắn.
Điểm tương đương không có giá trị không thay đổi và đổi khác tùy trực thuộc vào những hợp chất tương quan đến chuẩn độ.
-Bằng cách liên tục thêm Na
OH, sau khi đạt tới điểm tương đương, độ p
H tăng thêm do dư quá natri hydroxit.
Lựa lựa chọn chỉ số theo điểm tương đương
Phenolphtalein rất hữu ích trong vabishonglam.edu.vnệc xác định điểm tương đương trong phép chuẩn độ này, bởi vì nó tất cả điểm chuyển đổi màu ở p
H khoảng tầm 8, nằm trong vùng p
H của phép chuẩn chỉnh độ axit axetic bao gồm điểm tương tự (p
H = 8,72).
Mặt khác, đỏ methyl không hữu ích trong vabishonglam.edu.vnệc xác minh điểm tương đương, bởi vì nó chuyển đổi màu trong tầm p
H từ bỏ 4,5 mang đến 6,4.
Tài liệu tham khảo
Wikipedia. (2018). Điểm tương đương. Lấy từ: en.wikipedia.orgHelmenstine, Anne Marie, tiến sỹ (Ngày 22 mon 6 năm 2018). Định nghĩa điểm tương đương. Mang từ: thinkco.com
Lusi Madisha. (Ngày 16 tháng 4 năm 2018). Sự khác biệt giữa Điểm cuối cùng Điểm tương đương. "Sự không giống biệt
Bạn.net. đem từ: differb between.net
Nhìn J. (2018). Điểm tương đương: Định nghĩa & Tính toán. Mang từ: học.com
Whitten, K. W., Davabishonglam.edu.vns, R.E., Peck, L. Phường và Stanley, G. G. Chemistry. (2008) Phiên bạn dạng thứ tám. Biên tập vabishonglam.edu.vnên học tập tập.









